赵 欣,周雅琳,冯 霞
(重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067)
牦牛乳富含蛋白质和微量元素,营养价值优于普通牛乳,自然发酵牦牛酸乳具有特殊的风味和营养组成,还富含未经鉴定和开发的微生物资源[1-2]。从自然发酵牦牛酸乳中分离的乳酸菌发酵酸奶具有肠道调节、减脂和等保健功效[3-6]。另外,自然发酵牦牛乳中含有的微生物不仅种类丰富,还具有良好的抗性,是潜在的益生菌发掘资源[7]。
狼疮性肾炎是一种因免疫失调引发的肾炎,严重的肾脏疾病出现后常常导致狼疮性肾炎,进而引起肾小球炎症[8]。狼疮性肾炎发生后会引起机体一系列病变,除了肾小球炎症外,还会出现淋巴结增生,严重时机体免疫失调,出现肾脏硬化、代谢及排毒失调,从而危及生命[9]。机体免疫系统中B细胞及T细胞被过度激活也是狼疮性肾炎的主要表现,从而造成体内的T细胞出现分化,影响正常的免疫系统工作。有研究显示益生菌干预下能够保持T细胞在机体中的平衡,发挥益生菌干预肾炎的作用[10]。益生菌自身的肽聚糖和脂磷壁酸等成分能够激活和加强免疫系统,提高机体免疫力;
同时益生菌还能分泌出刺激免疫系统的活性物质,也能发挥提高免疫力的作用,机体免疫力提高后,炎症引起的体内毒性物质被加速排出,促进了肾脏病变的恢复[11]。降植烷是一种能够引起炎症和使免疫失调的化学物质,在动物体内能够使T细胞和B细胞的平衡被打破,造成动物机体免疫系统中出现异常抵抗,进而引发狼疮性肾炎,因此常被用于构建实验性狼疮性肾炎模型,以检测药物或功能性食品的功效[12-13]。Lactococcus lactissubsp.lactisHFY14(LLSLHFY14)是从四川红原高原藏族牧民自然发酵酸奶中分离出的一株菌,本研究通过降植烷诱导狼疮性肾炎建立实验动物模型,观察Lactococcus lactissubsp.lactisHFY14的肾炎改善作用,并且通过进一步的分子生物学实验分析Lactococcus lactissubsp.lactisHFY14发挥提高免疫力作用的机理。
Lactococcus lactissubsp.lactisHFY14分离于四川阿坝藏族羌族自治州红原县的自然发酵牦牛酸乳,该菌经过鉴定后在中国微生物菌种保藏管理委员会普通微生物中心进行了专利保藏,专利保藏号为CGMCC No.16647。
6 周龄的SPF级C57BL/J6小鼠,雌雄各半,共计50 只,体质量为(23±2)g,购于重庆恩斯维尔生物科技有限公司。本研究中动物实验经重庆市功能性食品协同创新中心动物实验伦理委员会批准,批准号为2021050008B。
降植烷(纯度≥98%) 美国Sigma公司;
泼尼松(纯度≥97%) 北京百灵威科技有限公司;
白细胞介素(interleukin,IL)-2、IL-12、干扰素γ(interferon gamma,IFN-γ)、免疫球蛋白G(immunoglobulin G,IgG)、转化生长因子-β(transforming growth factor beta,TGF-β)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒以及血清肌酐(serum creatinine,SCr)、总胆固醇(total cholesterol,TC)、血尿素氮(blood urea nitrogen,BUN)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、甘油三酯(triglyceride,TG)测定试剂盒 武汉赛培生物科技有限公司;
TRIzol试剂、SYBR绿色聚合酶链反应反应混合物(SYBR Green PCR Master Mix)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒、二喹林甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒 北京索莱宝科技有限公司;
定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)上下游引物、一抗、二抗 美国Thermo Fisher Scientific公司;
其余试剂均为国产分析纯。
BX43显微镜 日本奥林巴斯公司;
UV-2600i紫外-可见分光光度计、StoponePlus qPCR仪 美国Thermo Fisher Scientific公司;
5500Multi化学发光凝胶成像系统上海天能科技有限公司。
1.3.1 动物实验
C57BL/J6小鼠在控温((20±1)℃)控湿(30%~40%)环境下实用性喂养1 周。实验小鼠被随机分为正常组、模型组、LLSLHFY14低浓度作用(LLSLHFY14-L)组、LLSLHFY14高浓度作用(LLSLHFY14-H)组和泼尼松组(药物阳性组),每组10 只,雌雄各半。适应性喂养结束后对正常组小鼠腹腔注射0.5 mL生理盐水溶液,同时对其余各组小鼠腹腔注射0.5 mL降植烷[14]。注射降植烷后第2天开始,LLSLHFY14-L组和LLSLHFY14-H组小鼠每日按108CFU/kgmb和109CFU/kgmb剂量灌胃LLSLHFY14活菌溶液,泼尼松组小鼠每日按10 mg/kgmb剂量灌胃泼尼松溶液,正常组和模型组小鼠每日灌胃0.2 mL蒸馏水,各组灌胃样品12 周。12 周后采用毛细管眼眶取血对小鼠实施采血,然后断颈处死小鼠,解剖小鼠取内脏,称量胸腺和脾脏质量,根据式(1)、(2)分别计算胸腺指数和脾脏指数。
1.3.2 血清细胞因子质量浓度测定
将收集到的小鼠血液在4 ℃下1 500 r/min离心10 min,分离得到上层血清,然后根据ELISA试剂盒的方法对血清中IL-2、IL-12、IFN-γ、IgG和TGF-β细胞因子质量浓度进行测定[15]。
1.3.3 血清指标测定
通过1.3.2节方法分离出小鼠血清,按相应试剂盒方法对小鼠血清中的SCr、BUN、TC、TG、TP和ALB水平进行测定。
1.3.4 抗双链脱氧核糖核酸抗体测定
注射降植烷后第2天开始每两周(第2、4、6、8、10、12周)采用眼眶取血法对小鼠进行采血,然后以1.3.2节方法分离出小鼠血清后加入微孔板中,37 ℃下放置120 min,然后再加入双链脱氧核糖核酸(doublestranded deoxyribonucleic acid、dsDNA)抗体,与辣根过氧化物酶进行标记后与抗原结合,最后加入底物3,3’,5,5’-四甲基联苯胺进行显色,以显色与否判断是否为阳性[16]。
1.3.5 组织切片观察
解剖小鼠取出小鼠的右肾,然后用10%福尔马林进行固定。48 h脱水处理后,用石蜡包埋肾脏组织,再将包埋的组织进行切片,最后用苏木精-伊红(hematoxylineosin,H&E)染料对切片染色后用显微镜观察组织的病理学变化[17]。
1.3.6 qPCR分析
取0.1 g小鼠的左肾组织,然后加入0.9 mL生理盐水进行匀浆。然后加入1.0 mL的RNAzol对组织中的RNA进行提取。测定RNA提取液的OD260nm/OD280nm,计算RNA纯度和浓度,再将RNA提取液的质量浓度调整为1 μg/μL后进行反转录得到cDNA。将1 μL cDNA、10 μL SYBR Green PCR Master Mix、7 μL 无菌蒸馏水、1 μL上游引物和1 μL下游引物进行混合,于定量PCR仪中进行反应(95 ℃、60 s;
95 ℃、15 s;
然后40 个循环:55 ℃、30 s;
72 ℃、35 s;
95 ℃、30 s;
55 ℃、35 s),反应后用2-ΔΔCt法对相关基因进行计算和定量分析,以β-actin作为内参进行实验,引物设计如表1所示[18]。

表1 本实验中使用的引物序列Table 1 Primer sequences used in this experiment
1.3.7 Western blot分析
取0.5 g小鼠的左肾组织,加入1 mL放射免疫沉淀裂解液和10 μL苯甲基磺酰氟进行裂解,然后在4 ℃下12 000 r/min离心4 min,除去中间蛋白层溶液,然后用BCA蛋白定量试剂盒对蛋白进行定量并将蛋白稀释到质量浓度50 μg/mL。按4∶1体积比将稀释的蛋白液与缓冲液混合后在100 ℃下保温5 min,接着将混合液加入预制胶中进行垂直凝胶电泳,持续50 min后开始聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转膜。转膜完成后用含1 mol/L Tris-HCl缓冲盐溶液(Tris-HCl buffer salt with tween,TBST)的5%脱脂牛乳对PVDF膜进行1 h封闭,封闭完成后用TBST溶液洗膜。处理后的PVDF膜在25 ℃下于抗体稀释溶液中浸泡,在1∶500(IL-4、IL-1β或TGF-β抗体与TBST体积比)稀释的单克隆一抗中孵育2 h后再在1∶1 000(抗体与TBST体积比)稀释的羊抗鼠IgG二抗中孵育2 h。最后用Supersignal West Pico PLUS对PVDF膜进行填充后置于成像系统中观察[18]。
对待检测的指标进行3 次的平行测定,实验结果以平均值±标准偏差表示。使用单因素方差分析方法对数据进行差异显著性分析,并用Excel 2016软件作图。
如图1所示,通过计算小鼠的器官指数发现,正常组小鼠胸腺指数和脾脏指数高于其他各组,而模型组胸腺和脾脏器官指数则显著低于其他各组(P<0.05)。相比模型组小鼠,LLSLHFY14-L、LLSLHFY14-H和泼尼松均能够使胸腺指数和脾脏指数显著提高(P<0.05),LLSLHFY14-H和泼尼松提高的程度高于LLSLHFY14-L。

图1 小鼠的胸腺指数(A)和脾脏指数(B)Fig.1 Thymus (A) and spleen (B) indices in mice
如图2所示,模型组小鼠血清中的IL-2质量浓度和IL-12质量浓度显著低于其他各组(P<0.05),而IFN-γ、TGF-β质量浓度和IgG质量浓度显著高于其他各组(P<0.05)。正常组小鼠血清中的IL-2、IL-12、IFN-γ、TGF-β质量浓度和IgG质量浓度呈现出和模型组相反的趋势,IL-2和IL-12水平显著高于其他组,IFN-γ、TGF-β质量浓度和IgG质量浓度低于其他组。与模型组相比,LLSLHFY14能够使狼疮性肾炎小鼠血清中的IL-2、IL-12质量浓度升高并使TGF-β、IFN-γ、IgG质量浓度降低,且效果呈现剂量依赖性,高浓度的LLSLHFY14(LLSLHFY14-H)效果接近药物泼尼松,能使IL-2、IL-12、IFN-γ、TGF-β和IgG的血清质量浓度趋于正常组水平。


图2 小鼠血清中的IL-2(A)、IL-12(B)、IFN-γ(C)、TGF-β(D)和IgG(E)细胞因子水平Fig.2 Levels of IL-2 (A), IL-12 (B), IFN-γ (C), TGF-β (D) and IgG (E)in serum of the mice
如图3所示,正常组小鼠血清中TP和ALB的水平与其他各组相比均呈现出显著差异(P<0.05)。模型组小鼠的TP和ALB水平显著低于其他各组(P<0.05),而SCr、BUN、TC和TG水平则显著高于其他各组(P<0.05)。LLSLHFY14-H组小鼠血清中的TP和ALB水平低于正常组和泼尼松组,高于模型组和LLSLHFY14-L组;
而LLSLHFY14-H组的SCr、BUN、TC和TG水平高于正常组和泼尼松组,低于模型组和LLSLHFY14-L组。


图3 小鼠血清中的SCr(A)、BUN(B)、TC(C)、TG(D)、TP(E)和ALB(F)水平Fig.3 Levels of SCr (A), BUN (B), TC (C), TG (D), TP (E) and ALB (F)in serum of mice
在LLSLHFY14作用小鼠开始后的第2、4、6、8、10、12周对小鼠血清的dsDNA抗体进行检测。正常组小鼠在整个实验周期中血清dsDNA抗体均呈现阴性,第4周开始,模型组所有小鼠dsDNA抗体均呈阳性(表2),提示狼疮性肾炎动物模型诱导成功。LLSLHFY14和泼尼松抑制了小鼠狼疮性肾炎的阳性率,其中LLSLHFY14-H在4~6 周中呈现50%的阳性率,进入第10周后降低到40%,泼尼松在第6周呈现出50%的阳性率,随之降低,进入第12周降为30%,LLSLHFY14-H和泼尼松均能使阳性率降低。实验结果表明LLSLHFY14和泼尼松抑制了小鼠狼疮性肾炎的发病,高浓度LLSLHFY14的效果接近泼尼松。

表2 狼疮性肾炎小鼠血清的dsDNA抗体阳性率Table 2 Positive rates of anti-dsDNA antibody in serum of mice with lupus nephritis
显微镜下观察到正常组小鼠肾组织中细胞结构完整且肾小球形态正常,但是模型组小鼠肾组织中的肾小球出现包括破裂等形态的变化,同时肾脏细胞间还出现炎性浸润,总体呈现出严重的肾组织病变(图4)。泼尼松可以明显地减轻肾脏组织的病变,高浓度的LLSLHFY14(LLSLHFY14-H组)也一定程度地减轻了肾组织的病变,能够起到与泼尼松接近的效果。

图4 小鼠肾脏组织的H&E染色病理观察Fig.4 Pathological observation of mouse kidney tissues by H&E staining
如图5所示,通过qPCR和Western blot实验对小鼠肾组织的mRNA相对表达量和蛋白相对表达量进行了检测,结果显示模型组小鼠肾组织中的IL-1β和TGF-β mRNA和蛋白相对表达量均显著高于其他组(P<0.05),但IL-4 mRNA和蛋白相对表达量均显著低于其他组(P<0.05),正常组小鼠肾组织的IL-4 mRNA和蛋白相对表达量则均显著高于其他组(P<0.05),TGF-β和IL-1β mRNA和蛋白相对表达量均显著低于其他组(P<0.05)。相比模型组,LLSLHFY14-L、LLSLHFY14-H和泼尼松均能够显著上调狼疮性肾炎小鼠肾脏组织的IL-4表达和下调IL-1β、TGF-β表达(P<0.05),LLSLHFY14-H组和泼尼松组调控IL-4、TGF-β和IL-1β蛋白表达的能力无显著差异(P>0.05),但强于LLSLHFY14-L组。

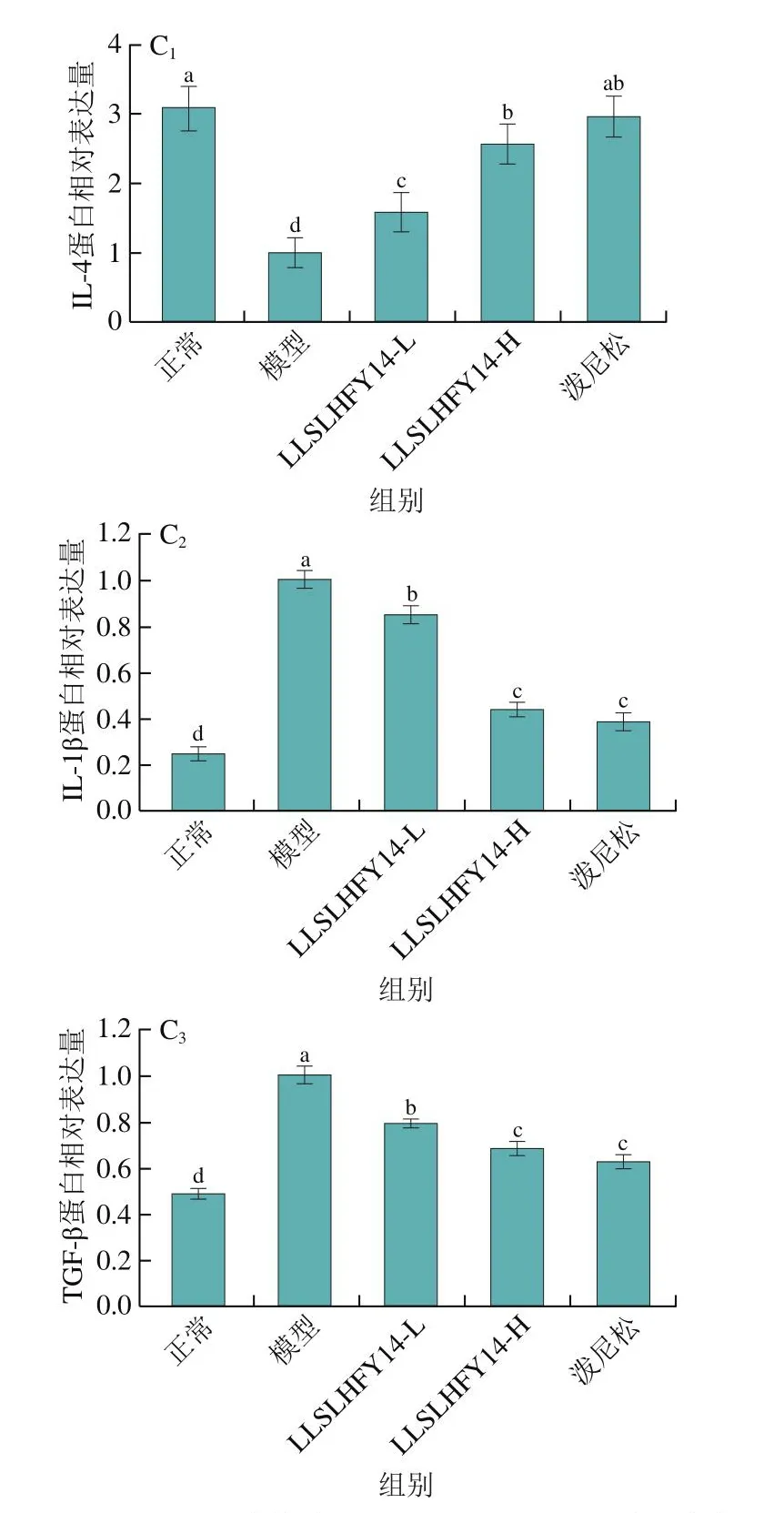
图5 小鼠肾组织中的IL-4、TGF-β和IL-1β mRNA相对表达量和蛋白相对表达量Fig.5 mRNA and protein expression of IL-4, TGF-β and IL-1β in mouse kidney tissues
狼疮性肾炎是一种与机体免疫异常直接相关的疾病,会导致机体内免疫复合物、免疫细胞、免疫细胞因子等异常。免疫器官指数能够直接反映小鼠内脏状况,免疫器官指数的提升是实验动物病症减轻、机体得到恢复的表现[19]。胸腺和脾脏是机体免疫系统的重要器官,免疫性疾病小鼠的胸腺和脾脏指数都会出现显著下降[20]。在本研究中狼疮性肾炎也造成模型组小鼠胸腺指数和脾脏指数下降,LLSLHFY14和泼尼松干预狼疮性肾炎小鼠后免疫失调得到抑制,胸腺指数和脾脏指数得到改善,特别是LLSLHFY14-H的效果接近药物泼尼松的作用,使器官指数趋于正常状态。
T细胞、自然杀伤(natural killer,NK)细胞和B细胞广泛分布在体内各个免疫器官和组织中,它们在机体内发挥重要的免疫调节作用。IL-2和IL-12可以增强T细胞活性,IL-12能够协同IL-2增强机体免疫力[21-22];
同时IL-2还可以刺激NK细胞的分化和激活,还能促进B细胞的增殖和分化以及免疫球蛋白的产生[21]。研究显示,肾小球损伤后免疫系统应激反应下,NK细胞和Th1急性反应下会产生大量的IFN-γ[23]。TGF-β在免疫调节中抑制免疫细胞活性和B淋巴细胞分化,对免疫系统的正常工作起到不利的影响[24]。IgG是机体内含量最高的一类免疫球蛋白,机体出现免疫性疾病的情况下血液中的IgG水平会异常上升,狼疮性肾炎临床患者的血清IgG水平也会表现出异常的升高[25]。IL-2、IL-12、IFN-γ、TGF-β和IgG的水平变化在本研究中显著体现在狼疮性肾炎小鼠血清中,LLSLHFY14的干预能够抑制这些变化,改善小鼠的免疫失调,从而改善狼疮性肾炎。
SCr与尿素氮都是含氮的有机化合物,作为蛋白质代谢在机体内的最终产物,通过肾小球正常过滤。但狼疮性肾炎发病时,肾小球过滤的能力下降,SCr与尿素氮在血清中水平异常提高,所以SCr与尿素氮水平也被作为临床诊断肾病的重要指标[26]。肾脏出现严重病变时会发生高钾血症,由此也会导致胆固醇与TG过度积累,这两个指标也被认为是肾功能异常的重要临床指标[27]。肾功能异常时会出现蛋白尿,造成血清中TP含量下降,同时还造成具有肾病治疗作用的ALB的含量也降低,保持机体内的TP和ALB水平正常也是维持肾功能的重要干预途径[28]。本研究中LLSLHFY14能够调节肾功能异常后的异常血清水平,从而起到改善狼疮性肾炎及其引起的肾功能异常的作用。狼疮性肾炎中的另一个关键生理变化是发病后会特异性的表现出dsDNA抗体[29],LLSLHFY14能够降低dsDNA抗体的阳性率,起到干预狼疮性肾炎发病的作用。
IL-4是重要的免疫调节物质,对B细胞和T细胞等免疫细胞都有调节作用,还可以对IFN-γ的mRNA转录起到抑制作用,从而起到缓解肾功能异常对机体造成的影响,改善免疫失调和肾功能异常[30]。IL-1β是免疫系统中的一个重要促炎因子,IL-1β过度产生是机体免疫应激反应和炎症的重要表现,现已有研究显示通过IL-1β受体拮抗剂调控IL-1β能够减轻狼疮炎症[31]。TGF-β在机体内的过度表达将加剧肾脏病变,增加肾纤维化的可能性[32]。本研究也证实狼疮性肾炎发病小鼠肾脏组织中的IL-4、TGF-β和IL-1β表达均出现异常,LLSLHFY14能够显著控制表达异常,从而起到改善肾功能的作用。
通过有益微生物干预狼疮性肾炎的研究还较少,有研究通过Lactobacillus oris、Lactobacillus rhamnosus、Lactobacillus reuteri、Lactobacillus johnsonii和Lactobacillus gasseri5 种有益菌灌胃小鼠干预狼疮性肾炎,发现L.reuteri能够改善小鼠肠道菌群,从而调节小鼠的免疫机能来起到干预狼疮性肾炎的作用[33],特别是这些有益微生物能够调节小鼠机体的IL水平来调控IgG2a和免疫机能,本研究中LLSLHFY14也能够对小鼠的多种IL(IL-1β、IL-2、IL-4和IL-12)水平起到改善作用,从而调节IgG水平和增强免疫机能。但是本实验未对小鼠的肠道菌群变化进行深入研究,为了更深入阐明LLSLHFY14的作用机制,未来研究应进一步分析肠道菌群变化。
本实验对一株来源于发酵牦牛酸乳的乳酸菌进行研究,对其在狼疮性肾炎中的作用和机制进行了初步探讨。研究结果显示,LLSLHFY14对狼疮性肾炎小鼠的免疫功能起到明显的调节作用,可进一步改善狼疮性肾炎引起的肾功能异常,其具备对狼疮性肾炎进行长期干预改善肾功能的应用潜质,效果接近于药物泼尼松。食品来源的微生物具有良好的安全性,LLSLHFY14具有作为益生菌发挥改善肾功能的应用价值,但仍需要人体临床试验来进一步深入验证。
猜你喜欢泼尼松肾炎机体Ω-3补充剂或能有效减缓机体衰老中老年保健(2021年7期)2021-08-22环磷酰胺联合泼尼松治疗类风湿关节炎的临床疗效观察中华养生保健(2020年1期)2020-11-16某柴油机机体的设计开发及验证柴油机设计与制造(2018年3期)2018-10-13大型卧浇机体下芯研箱定位工艺探讨中国铸造装备与技术(2017年3期)2017-06-21中西医治疗慢性肾小球肾炎80例疗效探讨中外医疗(2016年15期)2016-12-01奶牛肾炎的诊断与治疗中国乳业(2016年4期)2016-11-07解毒利湿汤治疗紫癜性肾炎42例临床研究中国卫生标准管理(2015年17期)2016-01-20乙肝相关性肾炎的临床特点及治疗中国继续医学教育(2015年3期)2016-01-06泼尼松联合吗替麦考酚酯治疗IgA肾病伴新月体形成的疗效及对脂联素的影响中国药业(2014年24期)2014-05-26甲基泼尼松龙在治疗急性脊髓损伤中的应用及研究进展中国医学科学院学报(2014年6期)2014-03-11扩展阅读文章
推荐阅读文章
恒微文秘网 https://www.sc-bjx.com Copyright © 2015-2024 . 恒微文秘网 版权所有
Powered by 恒微文秘网 © All Rights Reserved. 备案号:蜀ICP备15013507号-1